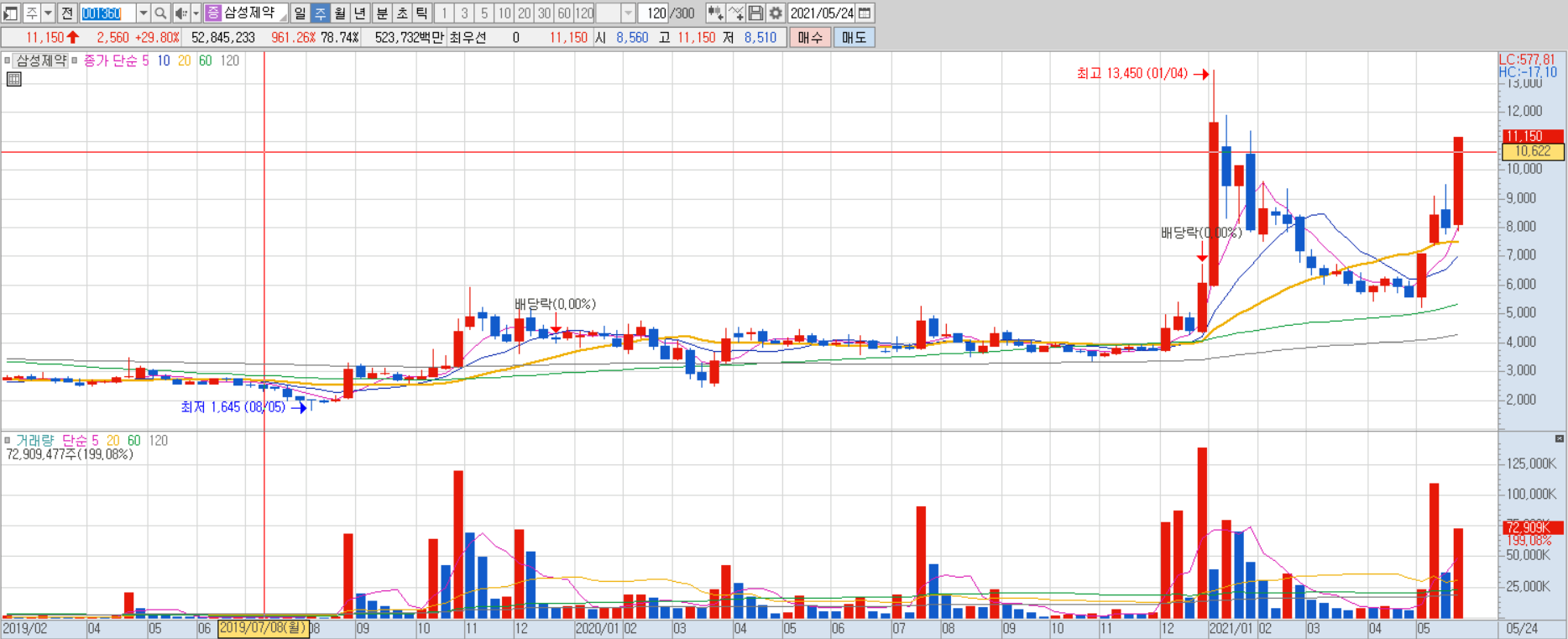
삼성제약 췌장암 치료제 리아백스주 임상 3상 결과 ASCO 공개 예정
삼성제약은 지난 20일, 췌장암 치료제 리아백스주의 임상 3상시험 결과를 다음달 4~8일까지 온라인으로 개최되는 미국종양학회(ASCO)에서 공개한다고 밝힌 바 있다.
관련 초록은 이미 ASCO 사이트를 통해 공개했는데 이에 대한 기대감이 반영되면서 상한가를 기록한 것으로 풀이된다.
삼성제약 일봉

삼성제약 주봉
췌장암 임상 진행상황 및 향후 추진일정
GV1001의 췌장암 임상(TeloVac Trial)의 경우 영국 리버풀의과대학을 포함한 51개 병원에서, 총1,062명의 환자를 모집, 완료 후 1년간 추적. 관찰기간까지 종료하여 미국 ASCO 학회에서 결과를 발표하였습니다.

NCCN(National Comprehensive Cancer Network) 가이드라인에 나와있는 기존 치료 방법인GemCap 항화학요법과 GemCap 과 GV1001의 항화학면역요법에 대한 중앙생존기간 비교 결과, 통계적으로 유의한 차이를 보이지는 않았습니다.
그러나 TeloVac 임상시험에 참여한 환자의 혈청 내 27총의 사이토카인을 분석하였고, 이 중 바이오마커인eotaxin의 중앙값(81.02 pg/mL)을 기준으로 high eotaxin과 low eotaxin로 분류하여 소그룹 분석하였을 시, GV1001 항화학면역요법군의 중앙생존기간이 high eotaxin군에서 월등히 길었음을 확인하였습니다(high eotaxin군: 14.8개월, low eotaxin군: 7.9개월). 뿐만 아니라 기존의 항암화학치료법과는 달리 뚜렷한 독성이 나타나지 않아, GV1001의 안전성을 확인 할 수 있었습니다.
최근에는 Telovac 결과에서 Bio-marker(바이오마커)와 환자들의 생존율 사이에 강한 연관성이 있다는 것을 규명해서 세계 최대의 암학회인 2014 미국 ASCO에서 발표하였습니다.
임상분석결과 이오탁신의 수치가 높은 환자군에서 GV1001을 투여받지 않은 환자군의 생존율 상위 5%그룹은 358일의 생존기간을 나타내었고, 반면 GV1001을 투여받은 환자군의 생존율 상위 5%그룹은 623일의 생존기간을 나타내었습니다. 이는 GV1001을 투여받은 환자군이 그렇지 않은 군에 비해 265일의 생존기간이 더 증가됨을 나타내는 결과입니다. 생존중앙값에서는 이오탁신의 수치가 높은 환자간의 GV1001을 투여받은 환자그룹과 투여받지 않은 환자그룹이 각각 451일과 299일로 152일의 차이가 발생하였습니다. 이에 따라 기존치료법인 화학치료제 GemCap과 GV1001을 병용 투여한 환자에 있어서 높은 이오탁신 수치가 환자의 생존율 향상의 예측을 가능하게 하는 바이오마커임을 입증하게 되었습니다.
당사는 최대주주 (주)젬백스앤카엘과의 라이선스 계약이후 이후 식품의약품안전처로부터 2015년 4월 29일 리아백스주(GV1001)에 대한 의약품 제조판매품목 허가를 받았으며, 여러 대형 병원에서 처방을 위한 절차를 밟았습니다. 이와 동시에 국내 3상 임상시험과 시판 후 의약품 안전관리를 동시에 진행하고 있습니다.
2020년 4월부로 췌장암 3상 임상시험을 종료하였고, 2020년 12월 28일 3상 임상시험결과보고서에 대해서 임상시험 안전성, 유효성 분석 결과를 공시하였으며, 2021년 6월 미국 ASCO 학회에서 결과를 발표할 예정입니다.
바이오 사업분야 및 진출목적
2015년 4월 당사는 (주)젬백스앤카엘과 췌장암 치료제인 리아백스주에 대한 국내 라이선스 계약을 체결하였습니다. 라이선스의 대가로 당사에서 발행한 전환사채 50억원을 지급하였으며, 당사는 리아백스주에 대한 국내 제조 및 공급, 판매할 권한을 받고, 임상시험 및 시판 후 의약품 안전관리에 관한 업무를 수행하기로 하였습니다. 기타 계약 조건으로 리아백스주에 대한 지식재산권 소유권과 국내 허가를 기초로 해외에서 허가를 신청하는 권한 및 해당 국가에서의 허가 이후 생산, 수입, 판매 등에 관한 권한은 (주)젬백스앤카엘에 있습니다.
리아백스주의 원료명인 GV1001은 폐암, 간암과 흑색종 임상 2상이 완료된 보편적인 항암면역치료제 입니다. 임상시험 단계별 성공확률은 71%, 44%, 69%로 이를 누적하여 환산하면 임상1상에서 3상까지 통과할 확율은 전체 신청건수대비 21.5%이며 신약신청에서 시판승인까지의 누적확율은 17.2%로 신약후보물질을 발견하였다 하더라도 임상시험 및 시판승인까지 모두 통과할 확율은 매우 낮은 것이 일반적입니다.
그러나 당사의 항암면역치료제 경우에는 통과확율이 낮은 임상 1,2상을 이미 완료한 상황이며 췌장암의 경우 Affitech사(전 Pharmexa AS)가 주도하여 영국 리버풀대학, 로얄리버풀, 브로드그린대학병원 NHS Trust와 "공급, 연구개발계약"을 체결하여 임상 3상을 진행 완료하고 2013년 미국 ASCO 학회에서 결과를 발표하였습니다. 또한 2014년 ASCO(미국 임상종양학회)에서 췌장암 임상 3상 (Telovac, 텔로백)에서 밝혀낸 GV1001과 바이오마커(eotaxin)의 상관관계를 규명한 결과를 발표하였으며, 2014년 9월 15일 국내 식품의약품안전처로부터 리아백스®주(코드명 GV1001)의 췌장암치료제 신약으로 품목허가를 승인 받았습니다. 2020년 8월 식품의약품안전처는 조건부허가 내의 임상시험결과보고서 제출 기한을 맞추지 못하여 조건부 허가 취소 결정을 내렸습니다. 당사는 2020년 12월 28일 관련임상 임상시험결과보고서 수령하였으며, 2021년 6월 미국 ASCO 학회에서 결과를 발표할 예정입니다.
'투자분석 > 제약, 바이오' 카테고리의 다른 글
| 얀센 백신 관련주, 티앤알바이오팹 vs 유한양행 (0) | 2021.06.01 |
|---|---|
| 제이시스메디칼, 피부 의료 미용기기 관련주 (0) | 2021.05.31 |
| 엔젠바이오 IR, 주요 사업 진행 현황 공유 (0) | 2021.05.28 |
| 셀트리온헬스케어, 렉키로나주 매출 영향 분석 (0) | 2021.05.28 |
| 메지온, 유데나필 NDA 신약허가신청 Filing 완료 공시 (0) | 2021.05.26 |




댓글