유데나필(Udenafil) 신약허가신청(NDA) Acceptance (Filing) 완료
1) 신청품목 : Udenafil
2) 신청 제출 기관
- FDA (미국 식품의약국)
3) 접수(Filing) 확정일 : 2021년 5월 25일 (미국 시간)
4) 내용
- 지난 3월 26일(미국 시간), FDA (미국 식품의약국)에 재제출한 신약허가신청에 대한 접수 완료

전자공시 투자판단 관련 주요 경영사항

NDA Filing 완료 안내





메지온 일봉
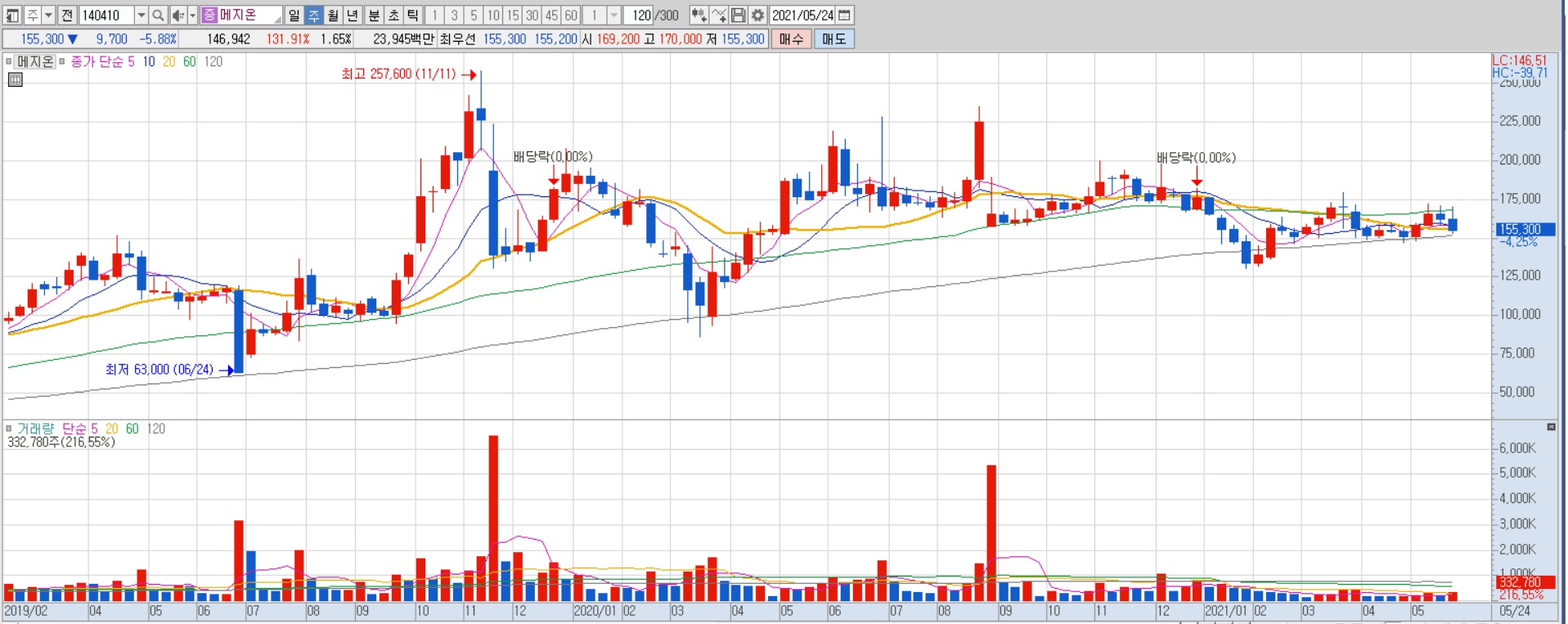
메지온 주봉
기다리던 Jurvigo의 NDA re-submission
메지온은 미국시간 지난 26일 PDE-5 억제제 Jurvigo의 신약허가 승인을 위해 미국 FDA에 NDA 제출을 완료했음을 밝혔다. 회사는 2020년 6월 이미 한차례 NDA를 제출하였으나 지난 8월 FDA로부터 자료의 보완을 요청받은 바 있다. 이 는 임상시험 결과에 대한 문제였다기 보다는 문서의 기술적인 보완사항이었으며, 회사는 FDA의 지적사항을 모두 해결한 후 다시 NDA를 제출한 것이다.
늦어도 올해 말에는 미국시장 출시여부 판가름
Jurvigo는 예비검토(preliminary review)를 통해 74일 내에 정식접수 여부가 결 정된다. 따라서 늦어도 6월초까지는 FDA의 본검토(substantial review) 진입여 부를 확인할 수 있을 것이다. Jurvigo는 이미 FDA로부터 우선심사(priority review) 대상으로 지정되었다. 따라서 일반적인 신약 검토기간인 10개월보다 단 축된 6개월 내에 신약허가 검토가 끝나게 된다. 따라서 늦어도 올해 말에는 Jurvigo의 미국시장 판매여부가 판가름 날 것이다. 그동안 회사는 미국에서 판매 채널을 구축하며 미국시장 출시를 준비할 계획이다.
이번엔 지난번보다 잘할 수 있는데 주가는 그대로네
지난 8월 23만원까지 상승했던 주가는 9월 FDA로부터 서류 보완 요청을 받으며 16만원대까지 하락했다. 그 후 주가는 꾸준한 약세를 보여 지난 1월에는 13만원 대까지 하락했다. 그 후 NDA 재신청에 대한 기대감으로 17만원선을 회복했으나 NDA 재신청 공시가 나온 전일 주가는 재료 소멸로 6% 하락 마감했다. 이번 제출 은 회사의 두 번째 시도로, 더욱 만전을 기한 만큼 결과가 긍정적으로 나올 가능성 은 한층 높아졌다. 그러나 현재 주가는 지난 9월 FDA로부터 보완 요청을 받고 급 락한 직후와 비슷한 수준이기 때문에 추가적인 하락은 제한적일 것이다. 오히려 지금은 6월에 있을 검토결과에 대한 기대감이 주가에 반영되기 시작할 시점이다. Jurvigo의 침투 가능 시장규모가 20억-30억달러에 달하는 만큼 올해 연말 FDA 로부터의 판매허가 획득은 주가의 강력한 모멘텀으로 작용할 수 있어 지속적인 관 심을 권고한다.
참고: 한국투자
'투자분석 > 제약, 바이오' 카테고리의 다른 글
| 엔젠바이오 IR, 주요 사업 진행 현황 공유 (0) | 2021.05.28 |
|---|---|
| 셀트리온헬스케어, 렉키로나주 매출 영향 분석 (0) | 2021.05.28 |
| 알테오젠, ALT-L9 국내 임상 1상 프로토콜 분석 (0) | 2021.05.26 |
| 엠아이텍, 글로벌 Top 5 비혈관용 스텐트 전문 기업 (0) | 2021.05.26 |
| 젠큐릭스, 유방암, 페암, 간암, 대장암 진단업계 강자 (0) | 2021.05.25 |




댓글